3.2 Chemisches Gleichgewicht
Lernziele
Materialien und Übungen finden Sie auf der Themenseite zum Chemischen Gleichgewicht.
- umkehrbare Reaktionen beschreiben und die Einstellung chemischer Gleichgewichte erläutern
Aufgabe
Führe die Experimente zum chemischen Gleichgewicht durch und bearbeite die Aufgaben.
- Berechnen Sie die benötigten Massen zur Herstellung der Lösungen aus Experiment 1a) bzw. berechnen Sie die Stoffmengenkonzentrationen der NaOH-Glucose-Lösung und der Methylenblau-Lösung aus Experiment 1b). Berechnen Sie die benötigte Masse zur Herstellung der Stärkelösung aus Experiment 2. (4 BE)
- Protokollieren Sie ihre Beobachtungen zu beiden Experimenten (1a) oder 1b)) (6 BE).
- Formulieren Sie die Wort- und Reaktionsgleichungen für beide Reaktionen (4 BE).
- Werten Sie Experiment 1 aus. Erläutern Sie an der Reaktionsgleichung das Konzept des dynamischen Gleichgewichts (4 BE).
- Werten Sie Experiment 2 aus. Erläutern Sie an diesem Beispiel das Konzept der umkehrbaren chemischen Reaktion sowie das Prinzip von Le Chatelier (2 BE + 4 BE).
Gesamtpunktzahl: 28 BE
Geräte und Chemikalien
1a) Einfluss der Konzentration auf das Chemische Gleichgewicht (Eisen(III)-thiocyanat)
- Reagenzgläser und Reagenzglasständer
- Pipetten
- Spatel
- Glasstab oder ggf. Reagenzglasstopfen
- Wasser
- Eisen(III)-chlorid-Lösung
- Ammoniumthiocyanat-Lösung
- Ammoniumchlorid
1b) Einfluss der Konzentration auf das Chemische Gleichgewicht (Blue-Bottle-Experiment)
- Rundkolben 400 ml + passender Stopfen
- Spatel
- Methylenblau-Lösung w=0,2%
- Natriumhydroxid

- Glucose
- Wasser
2) Einfluss der Temperatur auf das Chemische Gleichgewicht
- Reagenzgläser
- Bechergläser (ca. 100 ml)
- Spatel
- Glasstab
- Brenner
- Dreibein und Drahtnetz
- Tiegelzange
- Wasser
- Stärke
- Iod-Kaliumiodid-Lösung
Durchführung
1) Einfluss der Konzentration auf das Chemische Gleichgewicht (Eisen(III)-thiocyanat)
- Stellen Sie jeweils 20 ml einer wässrigen Lösung der Stoffe Eisen(III)-chlorid, Ammoniumthiocyanat und Ammoniumchlorid mit der Konzentration c = 0,00004 mol/Liter her.
- Geben Sie in einem kleinen Becherglas jeweils 10 ml der Lösungen von Eisen(III)-chlorid und Ammoniumthiocyanat zusammen. Die Lösung soll tief orange-rot werden.
- Füllen Sie nun 5 Reagenzgläser jeweils mit der gleichen Menge dieser Lösung (ca. 2 cm hoch).
- Schritt 1. Das erste Reagenzglas dient zum Vergleich. 2. Geben Sie in das zweite Reagenzglas 1 ml Eisen(III)-chlorid-Lösung. 3. Geben Sie in das dritte Reagenzglas 1 ml Ammoniumthiocyanat-Lösung. 4. Geben Sie in das vierte Reagenzglas 1 ml Ammoniumchlorid-Lösung. 5. Geben Sie in das fünfte Reagenzglas 1 ml Wasser.
1b) Einfluss der Konzentration auf das Chemische Gleichgewicht (Blue-Bottle-Experiment)
- Stellen Sie in einem Rundkolben eine Lösung von 1,25 g NaOH und 10 g Glucose in 100 ml Wasser her.
- Geben Sie anschließend 1,25 ml der Methylenblau-Lösung dazu und verschließen Sie den Rundkolben mit einem Stopfen.
- Sobald sich die Lösung entfärbt hat, erhält sie durch Schütteln ihre Farbe zurück. Dies kann mehrfach wiederholt werden.
- Wiederholen Sie den Prozess mehrfach, um die Einflussfaktoren auf das Chemische Gleichgewicht zu identifizieren.
2) Einfluss der Temperatur auf das Chemische Gleichgewicht
- Stelle 50 ml einer 0,5%ige (Massenprozent) Stärkelösung her. Wiege dazu die benötigte Menge Stärke ab und löse diese unter rühren in der entsprechenden Menge heißem Wasser auf. Filtriere gegebenenfalls. Die Lösung darf nicht so heiß sein, dass sie braun wird.
- Erhitze in einem Becherglas Wasser bis zum Siedepunkt. Fülle ein weiteres Becherglas mit Leitungswasser (ca. 20 °C).
- Fülle zwei Reagenzgläser jeweils zur Hälfte mit der Stärkelösung. Gib unter Rühren tropfenweise soviel Iod-Kaliumiodid-Lösung zu, dass sie blau gefärbt ist.
- Ein Reagenzglas wird abwechselnd in die Bechergläser mit kaltem und warmem Wasser getaucht.
- Das zweite Reagenzglas wird erst in warmes Wasser und anschließend zur Hälfte in kaltes Wasser getaucht.
Hinweise
1a) Einfluss der Konzentration auf das Chemische Gleichgewicht (Eisen(III)-thiocynat)
Es gilt folgende Reaktionsgleichung:
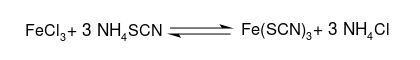
1b) Einfluss der Konzentration auf das Chemische Gleichgewicht (Blue-Bottle-Experiment)
Methylenblau wird durch Glucose zum farblosen Leukomethylenblau reduziert. Durch Sauerstoff erfolgt eine Oxidation zu Methylenblau.
2) Einfluss der Temperatur auf das Chemische Gleichgewicht
Iod bildet mit Stärke einen, je nach Konzentration, blauen bis lilafarbenen Iod-Stärke-Komplex.
Entsorgung
Die Reagenzgläser aus Experiment 1a) bzw. 1b) sowie Experiment 2 bitte im Kanister für anorganische Abfälle bzw. Schwermetalle entsorgen.
Literatur und Materialien
- Elemente Chemie 2 - Kapitel 4
- Simple Chemics - Chemisches Gleichgewicht und Massenwirkungsgesetz
- Simple Chemics - Le Chatelier