1.3.1 Daniell-Element
Lernziele
Materialien und Übungen finden Sie auf der Themenseite zu Galvanischen Elementen.
- die Entstehung der elektrochemischen Doppelschicht und die Bildung eines Elektrodenpotentials erklären
- den Aufbau galvanischer Zellen und die Bedeutung/Funktion der einzelnen Bestandteile am Beispiel erläutern
- die Potentialdifferenz in einer galvanischen Zelle bei Standardbedingungen berechnen
- den Zusammenhang zwischen Elektrodenpotential, elektrochemischer Spannungsreihe, korrespondierenden Redoxpaaren und dem Verlauf von Redoxreaktionen erklären
Aufgabe
Zeitaufwand: ca. 30 Minuten
-
Stellen Sie jeweils 10 ml einer Kupfer(II)-sulfatlösung und einer Zinksulfatlösung (Achtung: liegt als Heptahydrat vor) mit einer Konzentration von jeweils c = 0,1 mol/l her. Berechnen Sie vorab die benötigten Massen. (4 BE)
-
Fertigen Sie eine vollständig beschriftete Skizze des Daniell-Elements an. (7 BE)
Begriffe: Halbzelle, Elektrolyt, Elektrode, Stromschlüssel bzw. Salzbrücke, Anode, Kathode, Pluspol, Minuspol -
Führen Sie das Experiment durch. Protokollieren Sie die Beobachtungen. (1 BE)
-
Erläutern Sie Vorgänge an der Zinkelektrode in der Zink-Halbzelle an einer Skizze (Stichwort: elektrochemische Doppelschicht). (4 BE)
-
Formulieren Sie die Redoxgleichungen der ablaufenden Reaktionen (Halbzellen und Gesamtgleichung). (3 BE)
-
Berechnen Sie die Spannung des Daniell-Elements mit Hilfe der Standardpotentiale. Vergleichen Sie mit der tatsächlich gemessenen Spannung und bewerten Sie das Ergebnis. (4 BE)
-
Begründen Sie die Richtung des Stromflusses mit Hilfe der Standardpotentiale. (2 BE)
Gesamtpunktzahl: 25 BE
Geräte und Chemikalien
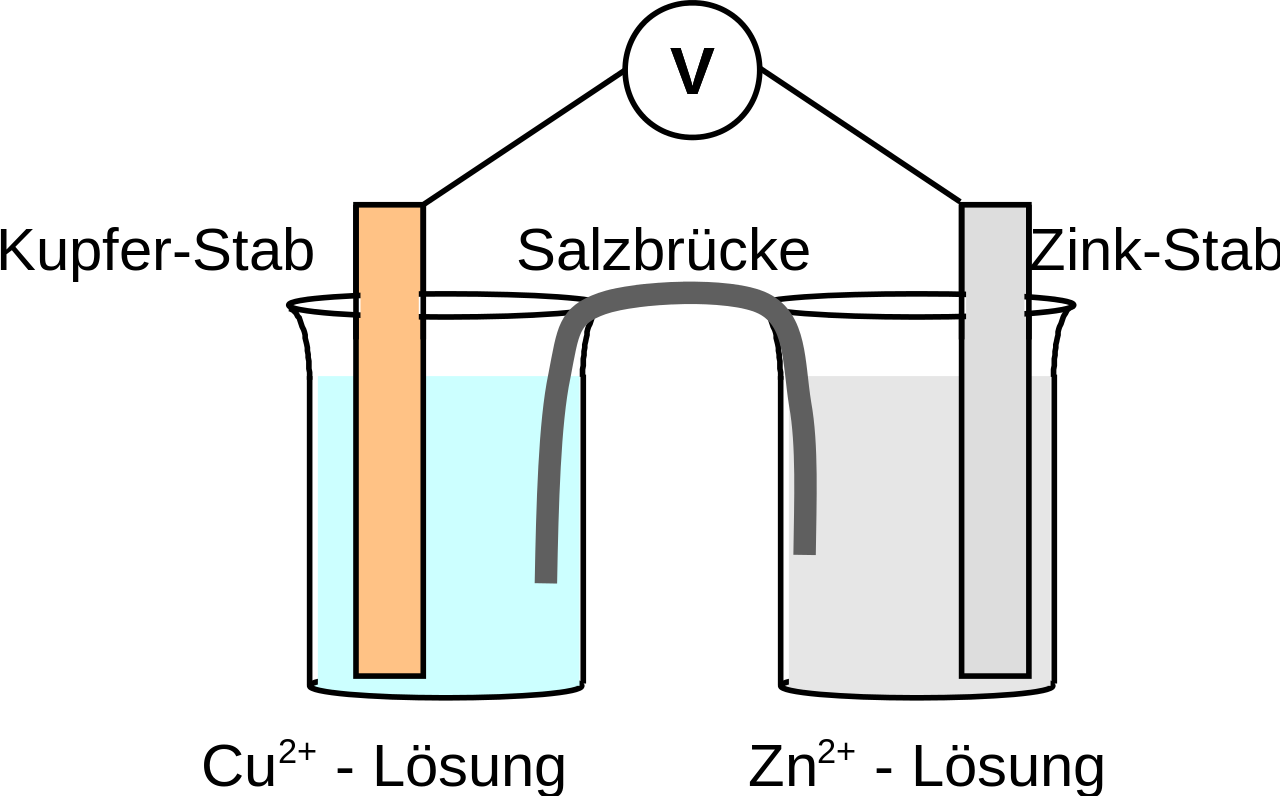
- Metallbleche: Kupfer, Zink
- Kupfer(II)-sulfatlösung, 0,1 mol/l (M = 249,7 g/mol als Pentahydrat)

- Zinksulfatlösung, 0,1 mol/l (M = 287,5 g/mol als Heptahydrat)

- Petrischale, zweigeteilt
- Filterpapier
- Multimeter
- ggf. Krokodilklemmen, Kabel und ein Motor
Durchführung
- Stellen Sie Lösungen der Metallsalze mit der Konzentration c = 0,1 mol/l her (jeweils 10 ml, Berechnung siehe Aufgabe 1).
- In eine Hälfte der Petrischale wird Kupfer(II)-sulfatlösung gegeben, in die andere Zinksulfatlösung.
- Die Metallbleche werden in die entsprechende Lösung getaucht: Zink zu Zn2+ und Cu zu Cu2+.
- Beide Hälften der Petrischale werden mit einem Streifen angefeuchtetem Filterpapier als Strombrücke verbunden.
-
Nun wird mit dem Multimeter zwischen beiden Elektroden die Spannung gemessen (Messbereich 2 Volt).
- Es kann statt des Multimeters auch mittels Krokodilklemmen und Kabeln versucht werden, einen Motor mit dem Daniell-Element zu betreiben.
Entsorgung
- Entsorge die Reste der Lösungen in den Kanister für anorganische Abfälle.
Literatur und Materialien
- Elemente Chemie 2: Seite 245-251
-
Simple Chemics - Elektrochemische Spannungsreihe
 bei 5:19: Denkt euch den Pfeil in die andere Richtung = Richtung des Elektronenflusses (von der Zink- zur Kupferelektrode)
bei 5:19: Denkt euch den Pfeil in die andere Richtung = Richtung des Elektronenflusses (von der Zink- zur Kupferelektrode) - Simple Chemics - Galvanisches Element